基于PROTACs技术的表观遗传抗肿瘤药物研究进展
吕倩倩,梁嘉杰,季红
(广州医科大学 药学院,广东 广州 511436)
2023.0790-基于 PROTACs 技术的表观遗传抗肿瘤药物研究进展-2024化学试剂第5期PDF文档.pdf
背景介绍
肿瘤一直严重威胁着人类的生命健康,因此抗肿瘤药物的研发一直是新药研究的重要方向。蛋白水解靶向嵌合体(PROTACs)技术是通过体内天然泛素蛋白酶体系统靶向降解目标蛋白,从而发挥抗肿瘤效应的新技术。目前已经开发了针对许多靶点的新颖、高效、低毒的降解剂。表观遗传蛋白主要调控肿瘤的迁移、侵袭、增殖等过程,是重要的抗肿瘤药靶。为了克服现有的靶向表观遗传靶点的药物易产生耐药性和毒副作用的缺点,采用靶向蛋白降解的新策略研发新的表观遗传药物具有重大意义。
文章亮点
1、首次综述了基于PROTACs技术的表观遗传抗肿瘤药物的研究进展;
2、总结了现有的靶向表观遗传靶点的各类降解剂的结构和最新进展,为这些药物的设计和进一步研发提供了重要参考;
3、展望了未来PROTACs技术在表观遗传抗肿瘤药物研发中的应用前景,为抗肿瘤药物研究提供了一种新思路。
内容介绍
1 PROTACs概述
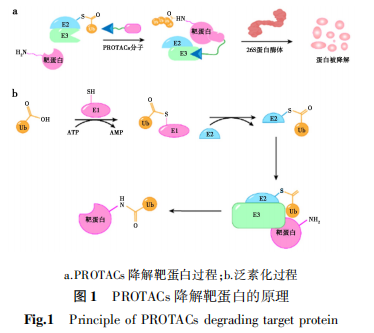
2022年,Crews等[11]提出了PROTACs概念,即利用细胞内的天然泛素蛋白酶体系统诱导靶蛋白降解的全新药物开发技术。PROTACs是由靶蛋白的配体和E3泛素连接酶配体通过连接子相连接组成的异源双功能化合物[12]。PROTACs分子结构中的靶蛋白配体可以靶向捕获靶蛋白,分子结构另一端的E3泛素连接酶配体便开始招募E3泛素连接酶到靶蛋白附近,形成“靶蛋白-PROTAC-E3泛素连接酶”三元复合物,为靶蛋白贴上“废弃物”(泛素化,Ubiquitin,Ub)标签。被Ub标记的靶蛋白被细胞内的蛋白酶体26S识别并降解。当靶蛋白被降解后,这种双功能分子能够多次循环发挥新一轮的降解作用[13](图1a)。PROTACs的泛素化过程是由一系列名为E1、E2、E3的泛素化酶介导的。首先,泛素甘氨酸端的羧基(-COOH)连接到泛素活化酶E1的巯基(-SH),这个步骤需要以ATP作为能量,使其在泛素和E1之间形成一个硫酯键(-S-CO-)。然后,E1将活化后的泛素通过交酯化过程交给泛素结合酶E2。最后,泛素连接酶E3介导泛素从E2上转运到靶蛋白的赖氨酸残基上,完成对靶蛋白的泛素化标记[14](图1b)。
2 表观遗传与肿瘤
表观遗传是指在基因的DNA序列不发生改变的情况下,对基因表达进行各类修饰,引起基因的功能发生可遗传的改变。表观遗传主要包括DNA甲基化、组蛋白修饰、染色质结构调控和非编码RNA调控[22]。作为一个新兴的研究领域,表观遗传学不仅对基因的表达、调控、遗传有重要作用,而且在人体生长发育、肿瘤、炎症等疾病的发生、发展、诊断和治疗中也起着十分重要的作用[23]。特别是在肿瘤领域,表观遗传为肿瘤的发生机制、环境影响和治疗方法等提供了重要线索,成为肿瘤研究的热点。
3 靶向表观遗传靶点的PROTACs抗肿瘤药物
3.1 PRC2降解剂
组蛋白甲基化是蛋白质和核酸的一种重要修饰,受组蛋白甲基转移酶和组蛋白脱甲基化酶调控,能调节基因的表达和关闭、DNA修复、干细胞的发育和分化以及DNA的复制等,与癌症、衰老、老年痴呆等许多疾病密切相关是表观遗传学的重要研究内容之一。
3.1.1 EZH2降解剂
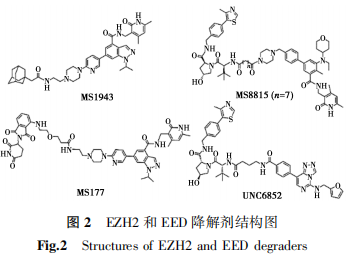
2020年,Ma等[38]设计了第一个口服的靶向EZH2降解剂MS1943(图2),MS1943可以选择性降解EZH2(IC50为120 nmol/L),体内活性评价显示,其能有效抑制三阴性乳腺癌细胞MDA-MB-468的生长。由于EZH2蛋白在多种癌细胞中均呈高表达,由此引起了生物医药学界的广泛关注。随后,Dale等[39]报道了一种新的选择性EZH2-PROTAC分子MS8815(图2)。
3.1.2 EED降解剂
Potjewyd等[41]基于EED抑制剂和VHL配体(VH032)设计合成了UNC6852(图2)。UNC6852采用含有3个亚甲基的短链烷基作为连接链,可以高选择性地降解EED、EZH12和SUZ3,导致H3K27me3水平降低,在弥漫大细胞淋巴瘤DLBCL中具有明显的抗增殖作用。
3.2 HDAC降解剂
组蛋白的乙酰化修饰是由组蛋白乙酰化酶(Histoneacetyltransferase,HAT)和HDACs共同调控的。通常情况下,组蛋白的乙酰化会激活基因表达,而去乙酰化则会抑制基因表达[42]。HDAC是一类参与染色质重塑和基因表达的关键蛋白,目前在人体中已经发现18种HDAC,分别属于4种类别(I、II、III和IV)[43]。
3.2.1 HDAC 1、2、3降解剂
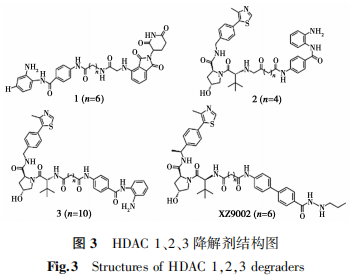
CI-994是早期研发的HDAC 1、2、3的选择性抑制剂。基于CI-994,以泊马度胺作为E3连接酶配体开发的一系列PROTACs,化合物1(图3)是最有效的非选择性HDAC降解剂[46]。在低浓度下能降解巨噬细胞RAW 264.7中的HDAC 3,在较高浓度下可降解RAW 264.7中的HDAC 1和HDAC 2。
3.2.2 HDAC 6降解剂
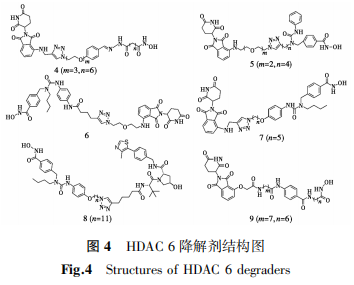
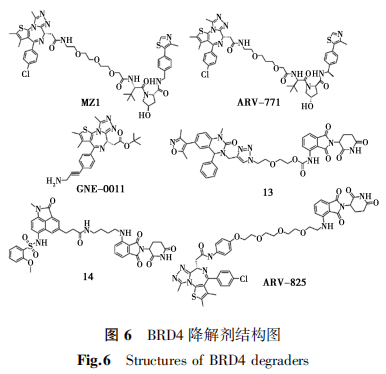
大量研究表明,HDAC 6在口腔鳞状细胞癌、急性髓系白血病、卵巢癌、肝癌等肿瘤中过表达,并与肿瘤进展、转移发生率和生存率下降呈现高度相关性,因此HDAC 6成为重要的抗肿瘤靶标之一[49]。Nexturastat A是一个重要的选择性HDAC 6抑制剂[50],目前的HDAC 6降解剂大多都是以Nexturastat A作为靶蛋白配体,利用E3连接酶CRBN或者VHL开发的。
3.2.3 HDAC 8降解剂
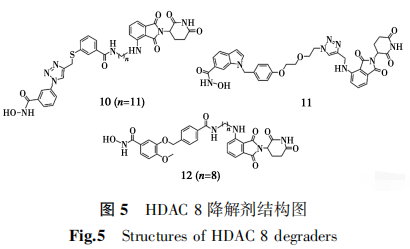
2022年,Chotitumnavee等[57]基于HDAC 8亚型选择性抑制剂NCC-149设计合成了一系列PROTACs,从中获得了首个HDAC 8亚型选择性降解剂10(图5),在人T淋巴母细胞Jurkat中对HDAC 8降解的DC50为0.70 μmol/L,对HDAC 1、HDAC 2和HDAC 6亚型未显示出明显的降解。
3.3 BRD4降解剂
溴结构域蛋白(Bromodomain-containing proteins, BRDs)可通过识别组蛋白的乙酰化赖氨酸残基并与之特异性结合,从而参与调控基因转录和染色质重塑等生命过程,是肿瘤细胞中最重要的表观遗传转录调控因子之一[60]。BRDs家族可分为8个亚家族,目前研究最多的是结构域和超末端结构域(BET)家族。BET家族由BRD2、BRD3、BRD4和睾丸特异性蛋白(BRDT)组成。
4 结论
表观遗传修饰与肿瘤的发生发展密切相关,其主要通过DNA甲基化和组蛋白修饰等方式参与基因表达的调控,从而促进肿瘤的发生和发展。在许多实体肿瘤中,DNA甲基化通常表现为全基因组的下调,而组蛋白修饰则可能导致肿瘤细胞中重要的信号转导通路的异常激活等。因此,表观遗传靶点一直是抗肿瘤药物发现的重要靶标。目前,靶向表观遗传靶点的小分子抗肿瘤药物主要包括DNA甲基转移酶抑制剂、组蛋白去甲基化酶抑制剂和HDAC抑制剂等。虽然这些小分子抑制剂的研发已取得很多重要进展,多个品种已上市或进入临床试验研究,但疗效不理想、毒性大、易耐药等仍然是其难以克服的缺点。
随着生物医学的发展以及交叉学科的飞速进步,PROTACs技术的出现彻底改变了药物开发的格局。简化PROTACs分子结构中特定靶点的小分子抑制剂的结构可能是优化PROTACs分子的一条有效途径。利用PROTAC原理和动态组合化学开发的细胞内点击形成的蛋白水解靶向嵌合体(CLIPTAC)技术可以通过快速点击反应自组装,并在细胞内形成功能性PROTACs分子,可以使其在细胞渗透性、溶解度上有明显改善,解决PROTACs分子因分子量大引起的问题。另外,综合运用各种药物制剂或递送技术,也可能为PROTACs药物面临的问题提供新的解决方案。此外,PROTACs分子的设计中,E3泛素连接酶的选择对于该类药物的研发也至关重要。相信随着PROTACs技术的不断发展和应用,靶向表观遗传靶点的PROTACs药物将在抗肿瘤治疗领域大放异彩。
引用本文:吕倩倩,梁嘉杰,季红. 基于PROTACs技术的表观遗传抗肿瘤药物研究进展[J].化学试剂,2024,46(5):1-9.
DOI:10.13822/j.cnki.hxsj.2023.0790



