引用本文:崔雨童, 韩佳铌, 唐燕琼, 等. 气囊蛋白基脑胶质瘤靶向诊疗一体化载体构建与性能评价[J]. 化学试剂, 2023, 45(11):25-31
DOI:10.13822/j.cnki.hxsj.2023.0430
背景介绍
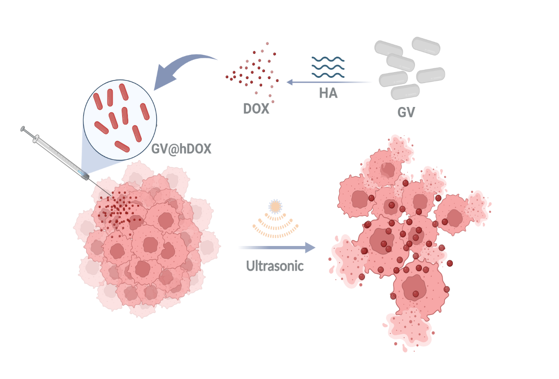
在脑胶质瘤的诊断治疗中,传统的载药系统有靶向性差、治疗效率低等问题。盐沼盐杆菌中存在的气囊蛋白(Gas vesicle, GV)因其在生物技术和医学方面的潜在用途而受到关注,它们可以被设计应用于药物递送和靶向成像等。因此,通过化学反应(EDC/NHS脱水缩合反应),将HA-DOX连接到GV的表面,制备具有靶向性的GV@hDOX载药系统,这使得药物能更有效地定位到脑胶质瘤细胞。GV@hDOX系统具有潜在的脑胶质瘤的诊断和治疗应用价值,并结合了靶向性、超声成像性能和治疗效果,为脑胶质瘤的诊断和治疗提供了新的途径。
文章亮点
1.设计了一种新型的纳米药物递送系统,其中以气囊蛋白(Gas vesicles,GV)作为载体,透明质酸(Hyaluronic acid,HA)用于靶向,并携带阿霉素 (Doxorubicin,DOX)作为药物;
2.GV@hDOX对小鼠脑胶质瘤细胞GL261显著提高了对DOX的吞噬效率,这表明该系统对于提高治疗效率具有潜在价值;
内容介绍
1 实验部分
1.1 主要仪器与试剂
1.2 实验方法
1.2.1 GV与GV@hDOX的制备
Halo细菌于100 r/min的37℃培养箱中培养20天后将菌液转入分液漏斗,继续培养10 d,直到在顶部形成粉红色分离层。打开旋塞阀,尽可能多地去除培养基,只保留红色细胞的漂浮层。加入等体积低渗裂解缓冲液(pH 7.5),裂解2 h。将裂解物转入离心管中,4 ℃下800 r/min离心4 h。在离心管顶部可看到一层混合的GV(白色)与未溶解的Halo(粉色)。将GV和未溶解的Halo细菌转移到新管中,加入PBS。重复离心。直到没有粉红色细胞溶解物的迹象。将纯化的GV重悬在PBS中,置于4 ℃保存。
将3.37 mg EDC和2.00 mg NHS加入10 mg HA溶液中,冰浴搅拌2 h后滴加1 mL(2 mg/mL)DOX。将反应混合物在4 ℃下继续搅拌24 h,获得HA-DOX。将3.37 mg EDC和2.00 mg NHS加入HA-DOX溶液中,然后在冰浴中搅拌2 h。加入1 mL(OD500=2.0)分散于PBS中的GV,4 ℃下搅拌24 h,所得混合物加入超滤管,1800 r离心5 min,去除游离EDC、NHS和HA,得到GV@hDOX并在4 ℃保存。
1.2.2 GV和GV@hDOX的表征
1.2.3 药物释放曲线测定
人参皂苷给药结束后,小鼠禁食2 h后注射乙醚使其麻醉,从眼眶静脉丛采集血样,采血结束后断颈法处死实验小鼠。在4 ℃下,用3000 r/min离心15 min,将全血标本放入新的EP试管。采用全自动生化分析仪,按说明书要求测定血清谷丙转氨酶(ALT)和谷草转氨酶(AST)的含量。
2 结果与讨论
2.1 GV@hDOX的表征
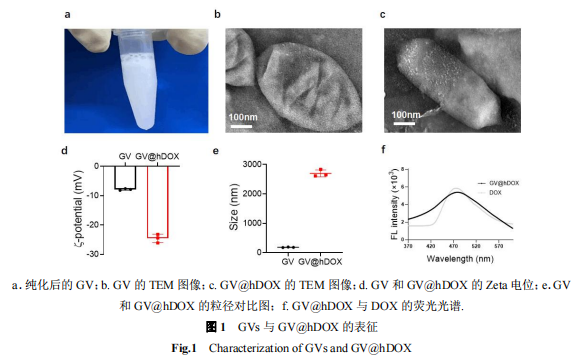
利用低渗裂解法裂解从Halo中提取气囊蛋白(图1a),对其尺寸、电位以及形貌进行表征。使用透射电子显微镜对其形态进行表征,GVs呈现均一的纺锤形晶体结构(图1b),经激光粒度分析仪测得气囊蛋白Zeta电位为-7.9 mV(图1d),水合粒径为(198 ± 35) nm(图1e)。
2.2 GV@hDOX的超声成像能力
为了研究HA-DOX在GV表面接枝对其超声成像能力的影响,在34 %、46%和55%的超声功率下,对PBS、GV、HA-DOX和GV@hDOX进行超声成像(图2)。

2.3 DOX的释放曲线
利用透析法对DOX、HA-DOX和GV@hDOX药物释放能力进行测定,检测并记录了DOX、HA-DOX和GV@hDOX在pH 6.5和pH 7.4下DOX的释放量(图3)。

2.4 GV@hDOX脑胶质瘤细胞靶向能力评价
由图4a、4c荧光强度变化可知,在4.0 h内,与DOX和HA-DOX相比,Raw264.7对GV@hDOX吞噬量无明显提高;6.0 h时,由于气囊蛋白的小尺寸效应增强了巨噬细胞的非特异性吞噬,GV@hDOX处理后的细胞具有更高的荧光强度。

2.5 GV@hDOX肿瘤杀伤能力和溶血率
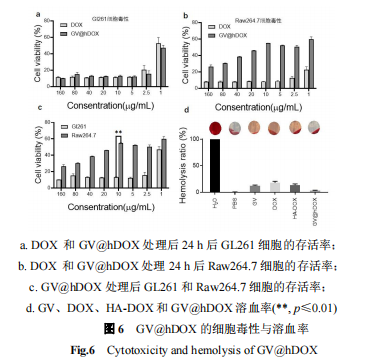
通过GL261细胞和巨噬细胞Raw264.7对DOX与GV@hDOX的细胞毒性进行检测,结果如图6所示。
3 结论
本研究利用从Halo中提取的GV作为药物递送载体,开发了一种新型脑胶质瘤诊断治疗策略。首先,通过将抗癌药物DOX接枝到HA上,得到HA-DOX——可作为CD44靶向分子。其次,HA-DOX和GV在EDC/NHS的存在下发生脱水缩合,得到GV@hDOX,用于构建诊疗一体化药物递送体系。
实验结果表明,HA-DOX能够接枝到GV的表面,并能提高GV的超声成像能力;由于HA对CD44受体的靶向作用以及GV的纳米尺寸效应,脑胶质瘤GL261细胞对GV@hDOX的吞噬效率提高,从而提高了GL261细胞的杀伤率。此外,GV@hDOX具有较高的细胞相容性和血液相容性。因此,鉴于其脑胶质瘤靶向作用、超声成像性能以及脑胶质瘤细胞杀伤作用,GV@hDOX可用于脑胶质瘤的诊断治疗。本研究为肿瘤靶向诊疗一体化体系的设计构建提供新的思路和方法,为进一步实现脑胶质瘤的高效治疗奠定了理论基础。



