自由基不对称反应研究进展
引用本文:周少方,冯勇,梁春华,等. 自由基不对称反应研究进展[J]. 化学试剂, 2024, 46(4):1-10.
DOI:10.13822/j.cnki.hxsj.2023.0799
背景介绍
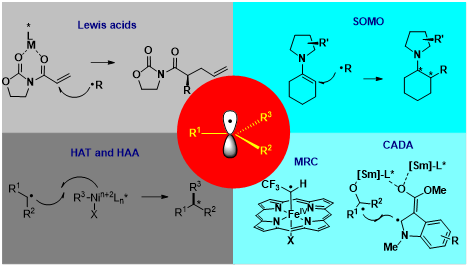
数十年来,控制自由基反应中的对映选择性一直是有机化学家面临的巨大挑战。近年来随着新策略和新的合成方法的出现,自由基不对称化学领域发展迅速。在此,我们综述了近几年来该领域最重要的贡献,并且根据控制立体选择性的不同策略对主要进展进行了分类,包括:(1)Lewis acids促进的自由基不对称反应;(2)有机小分子促进的自由基不对称反应;(3)新型不对称自由基环化反应;(4)基于单电子转移过程的过渡金属催化的不对称自由基反应;(5)基于攫氢过程的过渡金属催化的不对称氧化自由基偶联反应;(6)基于其他策略的过渡金属催化的不对称自由基反应。同时对自由基不对称化学领域的发展进行的展望。
文章亮点
1.阐述了自由基反应中的对映选择性控制的难点及其自由基不对称化学的重要意义;
2.综述了近年来自由基不对称化学反应新策略及其在有机合成中的应用;
3. 为新型的可控自由基反应类型的拓展和开发利用提供了参考。
内容介绍
1 自由基不对称反应的不可控性
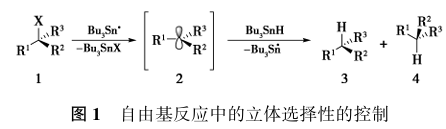
众所周知,对自由基反应中的立体选择性的控制所面临的首要难题是反应过程中所产生的大部分手性碳自由基中间体是平面或者近乎平面三角构型,因此上下两面参与反应的几率是均等的,从而导致外消旋产物的生成。例如卤代烃1在叔丁基锡自由基作用下产生sp2碳自由基中间体2,该中间体可以从两面同时攫取锡烃上的氢,从而得到1:1的外消旋混合物3和4(图1)。
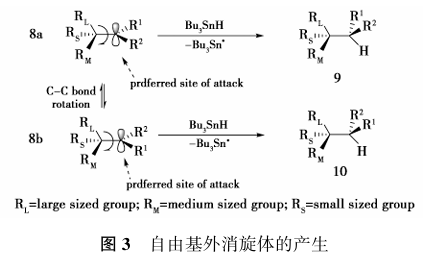
然而与环状自由基相比,非环状碳自由基由于存在C-C键之间的旋转而使得其立体选择性控制更加困难。例如非环状碳自由基8a可以选择性的与烷基锡反应得到单一的非对映异构体9,然而由于存在C-C键旋转,致使8a可以转化为8b,该自由基同样可以选择性的与烷基锡反应得到单一的非对映异构体10,因此,该反应会得到非立体选择性的混合物9和10。
这就意味需要降低或者阻止C-C键的旋转才能实现非环状手性碳自由基的立体选择性控制(图3)。
2 自由基不对称反应手性控制策略
2.1 Lewis acids促进的自由基不对称反应
Lewis acids催化的自由基不对称反应策略是目前为止研究较早且被广泛应用的一种控制自由基反应中立体选择性的策略。1995年,Wu等[9]首次利用该策略实现了非环状碳自由基的立体选择性控制(图4)。
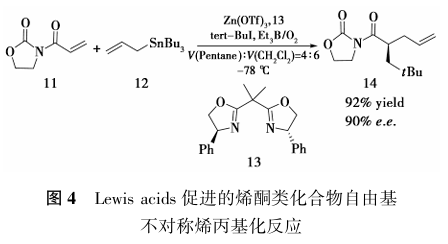
Sibi的报道为不对称自由基反应开辟了新的方向,在随后的几年里,基于Lewis acids促进的不对称自由基反应受到了广泛的关注和研究。例如:2003年,Friestad等[11]实现了Lewis acids促进的自由基对C=N双键的不对称加成反应;2002年,国内香港大学的Yang等[12]首次报道了基于溴原子转移的Lewis acids促进的自由基不对称环化反应;2006年,Miyabe等[13]又报道了自由基不对称Radical Addition–Cyclization–Trapping反应。
2.2 有机小分子促进的自由基不对称反应
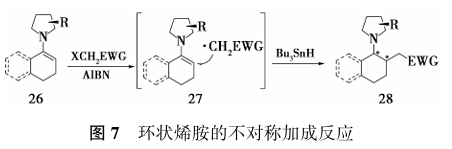
有机催化的自由基不对称反应通过包括3种不同的活化方式(Enamine, Iminium ion, and Dienamine activation)来实现其立体选择性控制[18]。这种策略在过去的二十年里被广泛应用。其中最早的研究是1990年由Renaud和Schubert报道的[19]自由基对预制环状烯胺的不对称加成反应。他们以40%~88%的收率以及最高95:5(Re/Si)的立体选择性得到了以反式非对映异构体为主的目标产物(图7)。
2.3 新型不对称自由基环化反应
不对称自由基环化反应是自由基化学中的一类重要反应,特别是在一些天然产物的合成中可以大大减少反应步骤,提高反应效率[34]。因此,不对称自由基环化反应一直是现在有机合成的热点之一。随着人们对自由基反应研究的深入,一些新型的反应策略,如:a)采用手性金属(Cu、Co、Ti等)试剂[35-37];b)采用手性锡试剂或者硫试剂[38];c)通过产生ketyl自由基[39]等,来实现不对称自由基环化反应。
2.4 基于单电子转移过程的过渡金属催化的不对称自由基反应
基于电子转移过程的过渡金属催化的不对称自由基反应利用烷基自由基与低价过渡金属物种通过电子转移形成高价过渡金属物种,再经过还原消除得到目标产物,是近3年来出现的一种新的控制烷基自由基立体选择性的策略,常被用于C(sp3)-H官能团化反应以及双键的双官能团化反应中。
2.5 基于攫氢过程的过渡金属催化的不对称氧化自由基偶联反应
C-H键直接官能团化反应是实现不对称合成的最简洁的策略,该策略具有更高的原子经济性,但是由于缺乏有效的手性配体,因此,利用氧化攫氢策略(HAA)产生自由基中间体,进而实现不对称催化仍是化学工作者面临重要挑战之一。
3 结论
综上所述,自由基反应的立体选择性控制一直是不对称催化领域的挑战性难题。目前已成功发展出了多种手性控制模式,并取得了令人欣喜的进展。毫无疑问,更多的研究努力将投入到这一研究方向中。但必须承认的是,目前自由基的种类仅限于烷基自由基,其他类型的自由基,比如,烯基、芳基自由基或者杂原子自由基,成功例子非常之少;在手性控制方面,目前的策略主要是通过手性催化剂与非自由基前体的底物作用,从而实现对自由基进攻方向的立体调控;而催化剂直接与活性自由基中间体作用的例子还十分罕见,这些应是不对称自由基反应未来需要努力开拓的重要方向。同时,目前实现不对称催化的反应类型还比较单一,因此,拓展新型反应类型也是值得关注的研究方向。



