
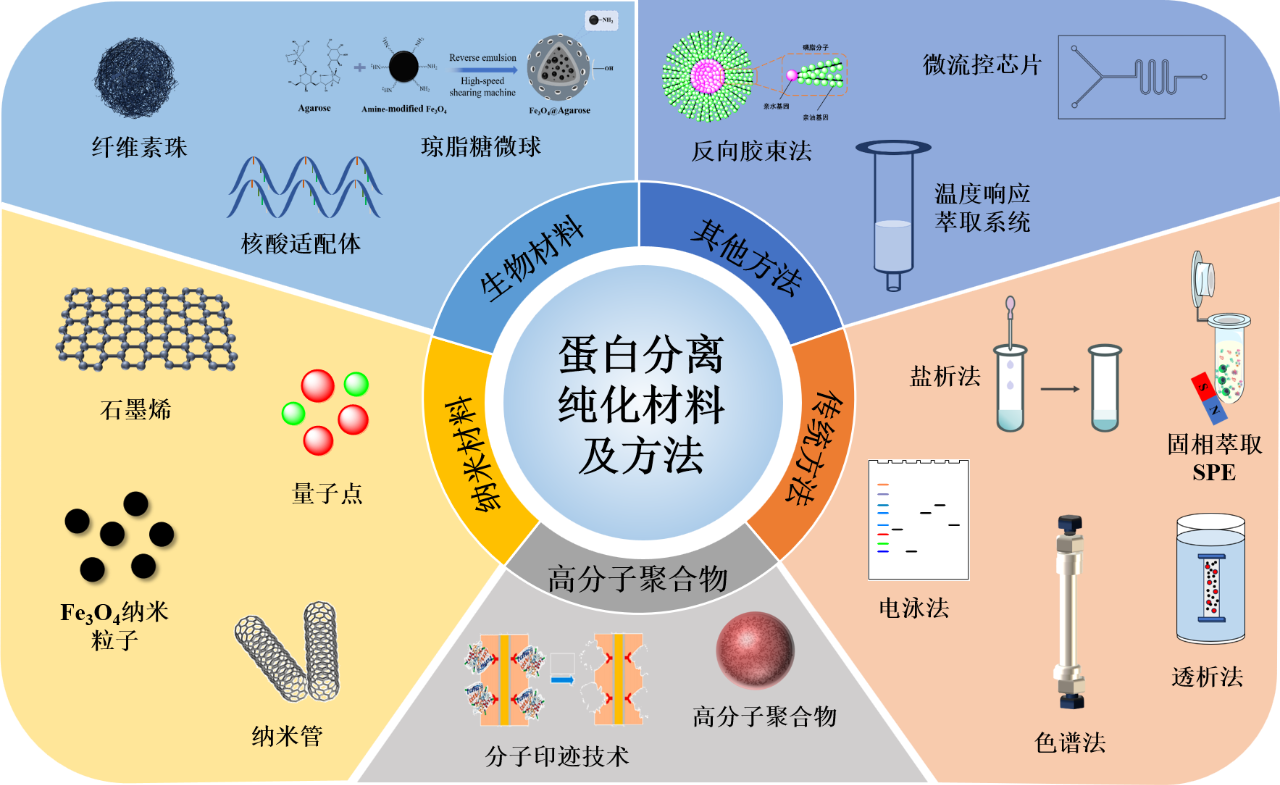
背景介绍
蛋白质分离纯化是生物技术及制药领域的核心环节,其效率直接影响后续应用。传统方法(如盐析、色谱、电泳等)虽成熟,但存在灵敏度低、操作繁琐等问题。近年来,新型材料显著推动了该领域革新:纳米材料(磁性颗粒、碳纳米管)凭借高比表面积和可功能化特性提升了吸附能力;高分子聚合物(如分子印迹材料)通过结构设计优化了纯化效率;生物材料(如核酸适配体)则实现了高特异性靶向结合。未来,蛋白质纯化技术将向智能化、自动化及绿色可持续方向发展,为行业创新提供新思路。
文章亮点
1. 文章系统梳理了传统蛋白质分离纯化方法的应用和局限性,以及新型蛋白分离纯化材料的制备及应用过程;
2. 研究对比了传统方法(如盐析、色谱)与新型材料的效率、成本及适用场景,提出根据需求选择技术组合的策略;
3.为未来蛋白分离纯化相关领域的发展提供了新的思路,还为生物制药、食品安全等领域提供了参考依据。
内容介绍
1 用于蛋白纯化的传统材料与技术
1.1 沉淀法
沉淀法是最早应用于蛋白质纯化的方法之一,基于溶解度差异达到蛋白质分离的效果。通过向蛋白质溶液中加入某些化学物质以降低蛋白溶解度,使其从中沉淀出来。沉淀法操作简便,成本较低,但分离纯度相对较低,常用于蛋白质的初步分离。根据沉淀原理的不同,沉淀法可分为盐析、有机溶剂沉淀、等电点沉淀等。
1.2 萃取法
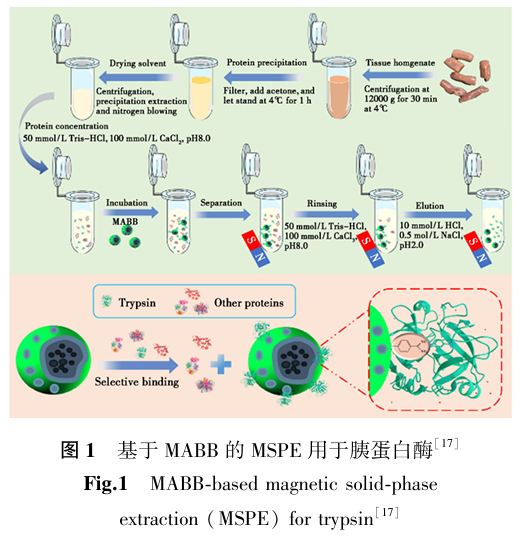
利用蛋白质在两种不相溶的溶剂中的分配差异进行分离的方法称为萃取法。常见的萃取体系包括双水相体系、固相萃取等。Zhao等[17]制备了微米大小的Fe3O4@琼脂糖-苯甲脒磁珠(MABB),对胰蛋白酶的最大吸附能力达1946 mg/g,引入磁性纳米粒子,构建了基于MABB的MSPE策略(图1),成功用于草鱼内脏中胰蛋白酶纯化,保证了纯化后的胰蛋白酶的生物活性。
1.3 电泳法
电泳法利用蛋白质在电场中的迁移速度差异进行分离。溶液的pH离蛋白质的pI越远,蛋白粒子携带的电荷越多,粒子移动的速度也就越快。电泳法分离度高,适用于蛋白质的精细分离和纯度鉴定。
1.4 透析法
透析法利用半透膜的选择透过性,使小分子物质和溶剂通过膜孔,而大分子蛋白质则被截留在膜内,一般与其他分离纯化方法相结合来提高蛋白质纯度,从而实现蛋白质的分离和纯化。
1.5 色谱法
色谱法因其优异的选择性和良好的分离效率,在分离纯化生物大分子的过程中是不可缺少的方法。Boughanmi等[23]研究介绍了一种高效的、利用反相高效液相色谱(RP-HPLC)提取毒液衍生蛋白的技术。重点关注梯度洗脱条件和色谱柱的固定相特性,以提高我们的分离的有效性。这使得6种毒液蛋白的分离得以一步完成。
2 用于蛋白纯化的纳米材料
2.1 磁性纳米材料
磁性纳米材料由于其快速分离、超顺磁性和生物相容性等各种能力[25],成为蛋白质组学、药物传递和基因传感领域的讨论课题。这些纳米材料也被称为磁性纳米颗粒(MNPs),他们具有更大的表面积,在纳米范围内更容易功能化,被认作蛋白质分离和分析方法的极好选择。
2.2 碳纳米材料
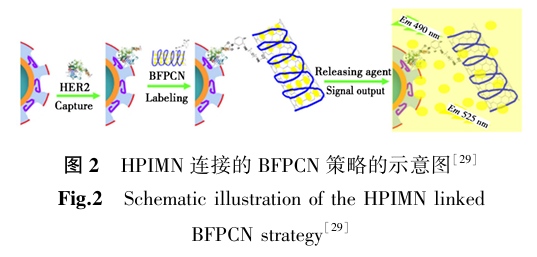
碳纳米材料包括碳纳米管和石墨烯等,具有较大的比表面积和独特的电学、力学性质。碳纳米管表面可以通过化学修饰引入亲水性基团或特异性识别基团,从而实现对蛋白质的选择性吸附。Yu等[29]将肽取向表面印迹磁性纳米颗粒与碳纳米管基荧光信号输出装置连接起来(图2)。
3 用于蛋白纯化的高分子聚合物材料
3.1 分子印迹聚合物
分子印迹聚合物(MIPs)是由模板分子和功能单体在引发剂的作用下形成的聚合物,具有定制的结合位点,模板分子被洗脱后,在聚合物中形成独特的印迹孔穴,实现特异性捕获。
3.2 功能化聚合物材料
近年来,聚合物因其柔性改性、高表面积、可调结构和稳定的物理化学性能等优良性能而被广泛研究。功能化聚合物是通过在聚合物主链上引入特定功能基团来实现对蛋白质的选择性识别和结合。Zhao等[38]以改性疏水性Fe3O4纳米粒子、苯乙烯和甲基丙烯酸缩水甘油酯为原料,通过两步分散聚合合成了微米级超顺磁性聚合物球体(图3)。

4 用于蛋白纯化的纳米材料
4.1 天然多糖材料
天然多糖,如壳聚糖、琼脂糖、纤维素等,具有良好的生物相容性和可生物降解性。壳聚糖是由甲壳素脱乙酰化得到的多糖,其分子链上含有大量的氨基和羟基。
4.2 生物分子衍生材料
以生物分子为基础衍生的材料在蛋白质纯化中展现出独特的优势。例如,蛋白质A和G能够特异性地结合免疫球蛋白的Fc段,广泛应用于抗体的纯化。
5 其他
5.1 微流控技术
微流控芯片将样品采集、分离、富集和检测等功能全部集成到芯片中,实现了生物样品分析和检测的集成、自动化,具有高效、高通量、低成本[51]的特点。
5.2 反相胶束
表面活性剂溶于非极性的有机溶剂中,当其浓度超过临界胶束浓度时,在有机溶剂内形成的胶束叫反胶束(Reversed micelle)或称反相胶束。
6 传统方法与新型材料的性能权衡分析
传统方法如沉淀法和色谱法在蛋白质纯化中具有成熟的应用基础,但其局限性显著。例如,沉淀法成本低廉且操作简单,但选择性和分离效率较低,仅适用于粗提阶段;色谱法虽选择性高,但依赖昂贵填料和复杂设备,难以满足高通量需求。相比之下,新型材料通过功能化设计显著提升了性能。
7 总结与展望
随着蛋白质纯化技术的不断发展,未来的蛋白纯化材料研究将聚焦于多功能性、智能化、绿色可持续发展以及低成本、简便制备等方向。多功能材料将集成磁性、荧光和亲和性等多种特性,实现蛋白质的高效分离与实时监测,满足生物制药中高纯度药物蛋白生产的需求,并为临床诊断提供精准的疾病检测手段。智能化材料能够根据环境变化自动调节对蛋白质的吸附和解吸,提高纯化效率和质量,有望在自动化蛋白纯化系统中发挥重要作用。同时,开发环境友好型纯化材料和工艺,减少有机溶剂使用,降低废弃物排放,符合绿色可持续发展的要求。此外,深入研究材料与蛋白质之间的相互作用机制,结合计算机模拟和先进表征技术,将有助于设计出更具针对性和高效性的纯化材料。解决材料的稳定性、重复性等问题,推动其在生物制药、临床诊断等领域的广泛应用,也将是未来研究的重点。
综上所述,蛋白质纯化材料的研究为蛋白质纯化技术带来了更多机遇和发展空间。随着材料科学、生物技术等多学科的交叉融合,相信会有更多性能优异、功能独特的新型蛋白纯化材料涌现,为蛋白质相关领域的发展提供有力支持。
青年编委介绍

董林毅
个人简介
董林毅,博士,教授,天津医科大学药学院副院长。近五年在Biosensors and Bioelectronics、Talanta等中科院一区论文20余篇,授权发明专利6项,主持完成国家自然基金、教育部产学合作育人等项目5项,参与编写全国职教药学本科教学质量标准、《药物分析》等十四五规划教材。指导学生获得国家级学术竞赛二等奖2项及国家级技能大赛特等奖1项。
主要研究方向
体内药物分析与中药分析,基于新型分离分析功能材料用于生物分离、疾病标志物分析、临床样品分析检测等领域研究
近五年代表作
[1] Zhao YQ, Li ZP, Dong SC, Wang H, Zhao YM, Dong LY*, Zhao ZY*, Wang XH*. Preparation of micron-sized benzamidine-modified magnetic agarose beads for trypsin purification from fish viscera. Talanta. 2024 Dec 1;280:126745. doi: 10.1016/j.talanta.2024.126745. Epub 2024 Aug 22. PMID: 39180874.
[2] Shi YJ, Che YN, Zhao YM, Ran RX, Zhao YQ, Yu SS, Chen MY, Dong LY*, Zhao ZY*, Wang XH*. High-efficient separation of deoxyribonucleic acid from pathogenic bacteria by hedgehog-inspired magnetic nanoparticles microextraction. J Chromatogr A. 2024 Jun 7;1724:464923. doi: 10.1016/j.chroma.2024.464923. Epub 2024 Apr 21. PMID: 38653039.
[3] Wang XY, Ji RY, Lang WW, Qin KX, Bai FY, Xi HY, Zheng Y, Xia BX, Dong LY*,Wang XH*. Integrating PEGylated peptide-oriented bacteria-imprinted matrix and PdPt bimetallic-doped imidazolium zeolite framework-8 for sensitive detection of Escherichia coli with smart phone read outsystem.SensorsandActuators:B.Chemical.2024.411.135749.
[4] Yang YS, Yu SS, Chen MY, Zuo D, Luo Y, Qiang T, Ma H, Yang XF, Ma YB, Wang XH*, Zhao ZY*, Dong LY*. Functionalized pyrite nanozyme probe and imprinted polymer modified with hydrophilic layer for rapid colorimetric analysis of glycoprotein in serum. Talanta. 2023 Aug 15;261:124665. doi: 10.1016/j.talanta.2023.124665.
[5]Sun Y, Luo Y, Sun L, Wang XR, Chen LW, Zhang N, Wang Y, Dong LY*, Guo H*, Wang XH*. Improving performance of cell imprinted PDMS by integrating boronate affinity and local post-imprinting modification for selective capture of circulating tumor cells from cancer patients. Biosens Bioelectron. 2023 Mar 1;223:115023.
课题组合影

课题组链接:https://tutors.eol.cn/web/index/details?service_id=1&tutor_id=875&act=do&rel=1



