19F磁共振成像引导的化学动力学/饥饿/化疗协同治疗纳米探针构建及应用
引用本文:刘晓彤,马景晶,胡高飞.19F磁共振成像引导的化学动力学/饥饿/化疗协同治疗纳米探针构建及应用[J].化学试剂,2024,46(2):28-38.
DOI:10.13822/j.cnki.hxsj.2023.0715
背景介绍
癌症作为当今人类最致命的疾病之一,因其造成的死亡率仍在不断增长。目前,常用的癌症治疗方式仍采用传统的化疗、放疗和手术治疗等。纳米医药材料由于独特的特性,包括本征的光、电、磁等特性,以及小尺寸、比表面大,表面可修饰和高负载特性,且生物相容性良好,或将成为未来医药领域的新型生物成像、诊断和治疗药物或载体。特别是具有不同性质的纳米材料的组合可以构建协同的多功能纳米医学平台,使多模态成像、同时诊断和治疗成为可能。
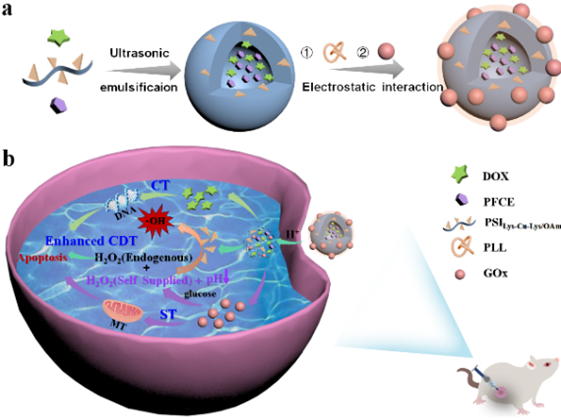
文章亮点
1.设计并制备了一种多功能成像与化学动力学(CDT)/饥饿(ST)/化疗(CT)联合治疗的纳米复合探针;
2.探针同时具有酸响应性(基于其中两亲高分子遇酸性环境解离特性),在肿瘤环境将响应性释放化疗药物DOX及Cu、GOx等,最终实现19FMR成像引导的CDT/ST/CT协同治疗;
3.该工作为合理设计和构建成像引导,并具有级联反应协同治疗的多功能纳米探针提供了新方法和策略。
内容介绍
1 实验部分
1.1 主要仪器与试剂
1.2 实验方法
1.2.1 赖氨酸铜配合物(Lys-Cu-Lys)的合成
将0.04 mol L-赖氨酸盐酸盐(L-Lys)溶于40 mL超纯水中,连续超声处理,待溶液至澄清透明后,将10 mmol碱式碳酸铜在60 ℃水浴条件下缓慢加入。然后在650 r/min条件下搅拌2 h,反应结束后趁热过滤,获得深蓝色澄清滤液。将滤液减压蒸馏除去部分水,直至瓶壁析出蓝色固体,静置一段时间。待瓶中固体大量析出后,转移至布氏漏斗中抽滤,多次用乙醇洗涤滤饼,得到蓝色固体产物Lys-Cu-Lys并将其烘干后干燥保存。
1.2.2 赖氨酸铜及油胺共修饰聚琥珀酰亚胺高分子(PSILys-Cu-Lys/OAm)的合成
将干燥后的PSILys-Cu-Lys超声溶解于32 mL DMF中,在90 ℃条件下搅拌均匀再向其中加入2.3 mL油胺(OAm),然后将混合物在100 ℃,650 r/min条件下搅拌5 h。反应结束并冷却后加入大量甲醇沉淀产物,离心处理后蒸干多余的甲醇,最终产物PSILys-Cu-Lys/OAm分散于二氯甲烷中备用。
2 结果与讨论
2.1 探针的组成和形貌结构表征
如图2所示,基于PLL的静电调节作用吸附葡萄糖氧化酶(GOx)后,获得最终纳米复合探针DFPPG呈球形纳米颗粒,分散性良好。各纳米探针相应动态光散射(DLS)粒径分布呈现逐渐增大的趋势,而且zeta电位显示PLL有效调节了探针表面电荷呈明显正电性,继而吸附GOx后最终DFPPG探针表面恢复为负电性。
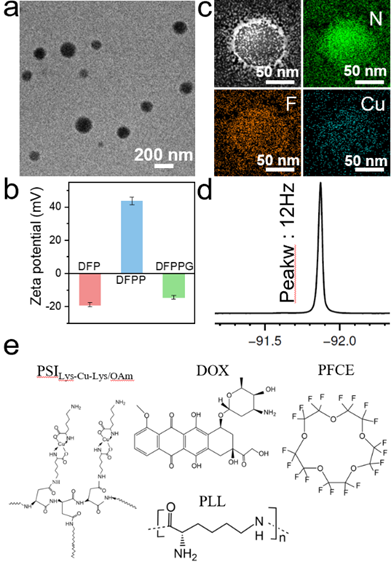
图2 探针的组成和形貌结构表征图
2.2 探针性能表征
如图3所示,DFPPG具有理想的酸响应性,因而有利于肿瘤环境下可控释放治疗剂,同时降低对正常组织的损伤。此外,葡萄糖氧化酶和类芬顿级联催化增强了CDT,同时实现了ST/CDT/CT(化疗)协同治疗效果。
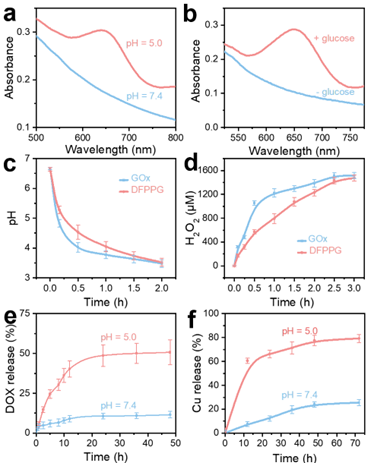
图3 探针性能表征图
2.3 探针的稳定性及细胞毒性考察
对DFPPG在PBS缓冲溶液(pH 7.4)中两周内的稳定性进行了考察,探针DLS尺寸变化与溶液19FNMR信噪比(SNR)及半峰宽(Peakw)变化均很小,表明探针在溶液中稳定性良好(图4)。
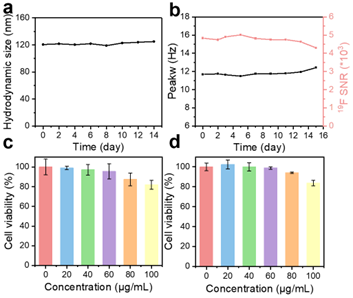
图4 探针的稳定性及细胞毒性考察性能图
3 结论
本文构建了一种19F磁共振成像引导的化学动力学/饥饿/化疗协同治疗的新型多功能纳米探针:DOX/F@PSILys-Cu- Lys/OAm@PLL-GOx(DFPPG)。首次将赖氨酸铜配合物共价接枝到PSI聚合物链上,获得的两亲性高分子PSILys-Cu- Lys/OAm对于探针自组装起到关键作用,同时赋予探针Cu介导的CDT功能和酸响应性解离特性。在肿瘤环境,探针响应性释放功能分子,其中GOx催化消耗葡萄糖生成H2O2和葡萄糖酸,既“饿死”肿瘤细胞,同时又提高了细胞内H2O2浓度,且葡萄糖酸可降低肿瘤环境酸度,更增强了CDT。同时,释放的化疗药物DOX进一步促进了肿瘤细胞的凋亡,实现了3种模式协同治疗效果。此外,基于PFCE的19FMRI可引导示踪深层组织中探针或药物代谢过程。体外及活体实验结果展现了该探针良好的肿瘤抑制效果及生物安全性。本研究为合理设计和构建成像引导,并具有级联反应协同治疗的多功能纳米探针提供了通用且有前景的新策略。



