
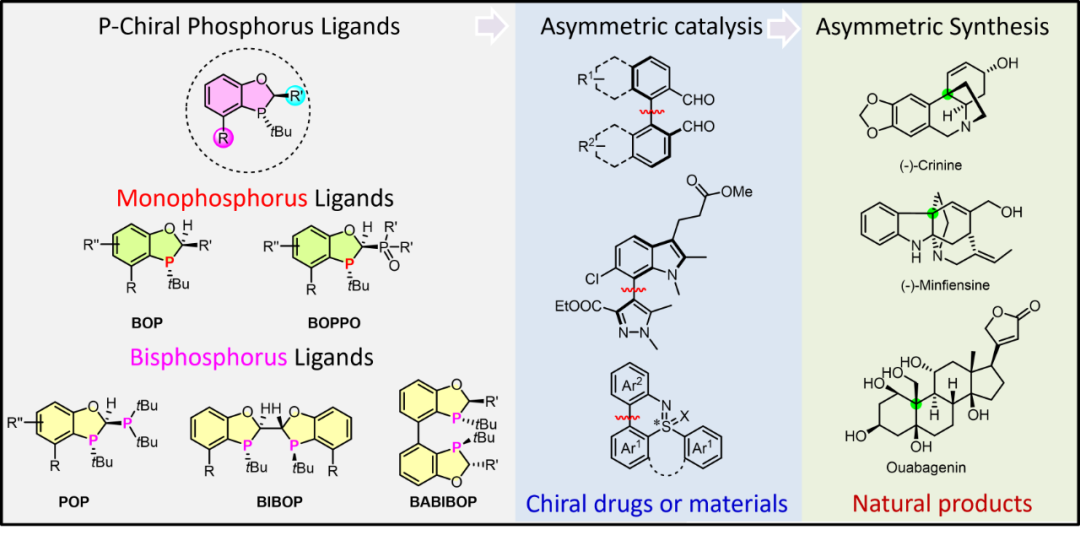
背景介绍
在现代药物合成尤其是手性药物的合成中,不对称催化技术是实现药物高效、规模化制备的核心,膦配体因其电子和空间位阻可调节性在不对称催化领域发挥着举足轻重的作用。虽然市场上有部分膦配体得到工业化应用,如具有轴手性的联萘基骨架膦配体和面手性的二茂铁骨架膦配体,但大多对空气较为敏感且结构难以修饰,而磷手性二氢苯并氧杂膦烷配体是一类大位阻、富电子、结构可调且性质稳定的膦配体,在众多有机转化中表现优异且呈现独特的催化特性,在KRAS轴手性药物的制备中表现尤为突出。因此,总结该类配体在众多催化反应及合成中的应用显得很合时宜。
文章亮点
1.本文详细阐述了系列结构独特的磷手性二氢苯并氧杂膦烷配体,该类配体性质稳定、位阻电性可调且实现规模化制备;
2.系统地总结了该类配体在偶联反应、加成反应、环化反应及氢化反应中的应用;
3.重点突出了该类配体在不对称偶联、不对称碳氢键活化及不对称去芳构环化反应中的独特催化特性;
4.该研究不仅为配体设计提供了新思路,也为药物制造等工业应用提供了新选择。
内容介绍
1 磷手性二氢苯并氧杂膦烷配体在偶联反应中的应用
交叉偶联反应已成为构建碳碳键、碳杂键最有效的策略之一,在有机合成化学、药物化学和材料科学领域的应用日益广泛。基于二氢苯并氧杂膦烷骨架的磷手性单膦配体已被证实是多种交叉偶联反应的高效催化剂,尤其是不对称偶联在轴手性药物合成发挥着至关重要的作用。本节重点阐述了其在以下领域的进展:包含高效大位阻碳碳键偶联、不对称Suzuki-Miyaura偶联、不对称Heck类型反应、不对称碳氢键芳基化、不饱和碳碳键的不对称官能团化、烯丙位的不对称官能团化以及其他偶联反应。
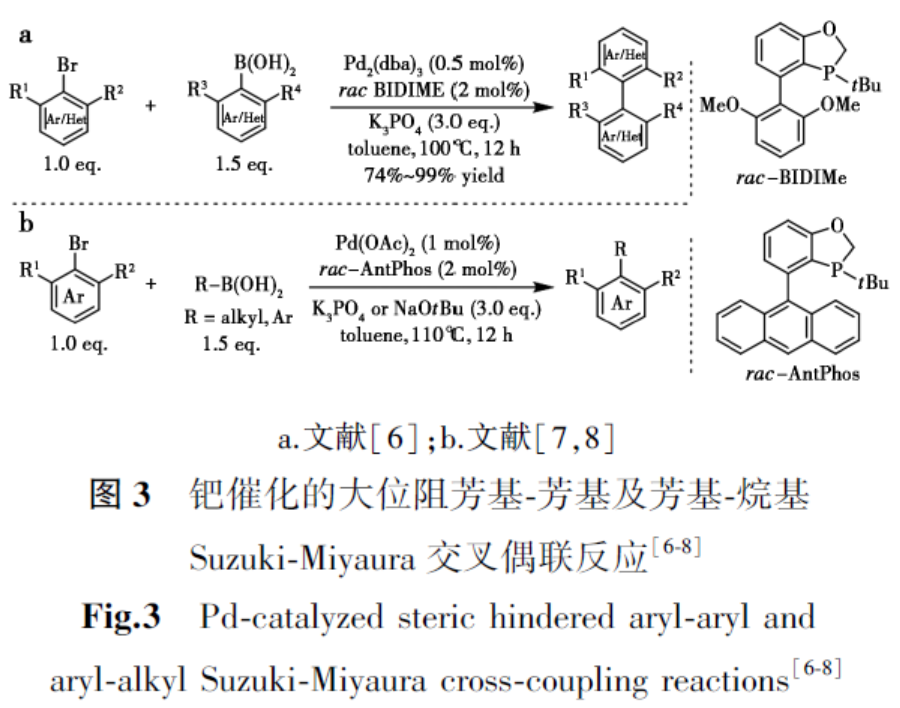
1.1 高效大位阻碳碳键的偶联
过去数十年间,关于大位阻Suzuki-Miyaura交叉偶联反应的研究成果较为有限。Buchwald团队曾报道使用菲罗啉单膦配体通过Suzuki-Miyaura交叉偶联构建四邻甲基取代联芳烃的方法,但该策略中两个邻位取代基仅限于甲基。2010年,Tang等[6]利用二氢苯并氧杂膦烷配体BIDIME或AntPhos,在低催化剂负载量下成功实现了邻位四取代联芳烃的合成(图3a)。值得注意的是,该方法可兼容异丙基、异丙氧基等大位阻取代基,收率最高达99%。随后,通过使用相同催化剂体系,进一步实现了邻位双取代卤代芳烃与仲烷基硼酸之间的大位阻芳基-烷基Suzuki-Miyaura偶联。该方法的高效性在分子齿轮化合物的合成中得到充分验证,以优异收率获得目标产物(图3b)[7,8]。
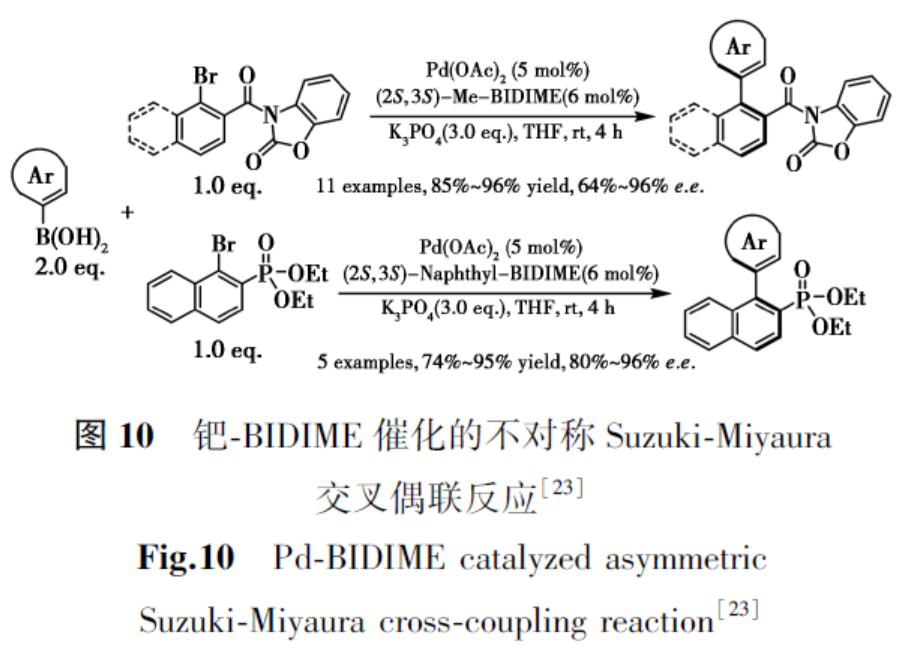
1.2 不对称Suzuki-Miyaura偶联
轴手性联芳烃结构广泛存在于多种生物活性天然产物和药物活性成分中[20,21]。不对称Suzuki-Miyaura交叉偶联仍是构建多样化轴手性联芳烃最直接、通用且经济高效的方法[22]。2012年,Tang等[23]报道了采用2-取代BIDIME手性配体,通过钯催化不对称Suzuki-Miyaura偶联反应高效构建系列功能化手性联芳烃的新方法(图10),该反应兼具高收率与优异对映选择性(e.e.值高达96%)。
1.3 不对称Heck类型的偶联反应
1.4 碳氢键的芳基化反应
2 磷手性二氢苯并氧杂膦烷配体在不对称加成反应中的应用
2.1 对碳氧双键的加成
2010年,Fandrick等[56]报道了使用MeO-BIBOP作为配体,铜催化醛与丙炔基硼烷试剂的高效不对称丙炔基化,以优异收率和对映选择性(90%~99% e.e.)提供了一系列手性高炔丙醇(图30)。该方法显示出广泛的底物范围,包括芳基、杂芳基、烯基和烷基醛。Trost及其合作者进一步将该方法应用于bryostatin 3的全合成,对烯醛进行丙炔基化,收率和对映选择性优异(86%,98% e.e.)[57]。

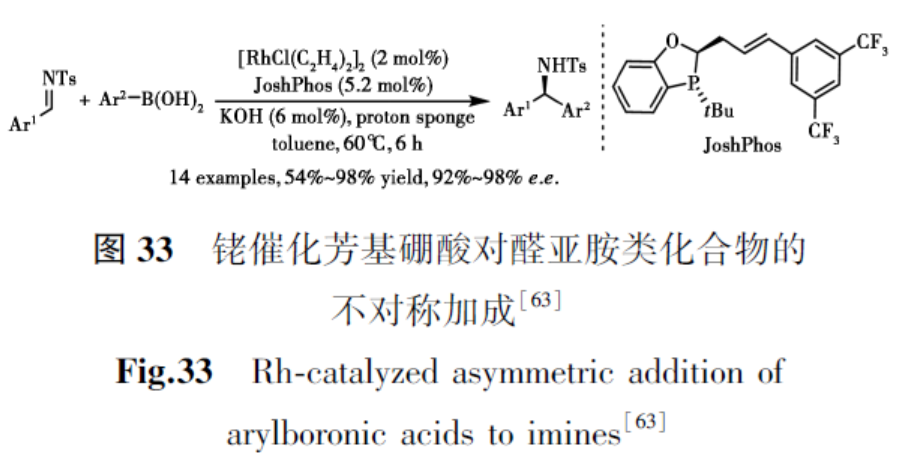
2.2 对碳氮双键的加成
2014年,Sieber等[63]开发了一种新型的p,π-二氢苯并氧杂膦烷杂化配体,并应用于铑催化芳基硼酸与亚胺亲电试剂的不对称加成,以优异的对映选择性合成多种手性叔胺(图33)。推测机理可能涉及形成Rh-p,π二聚体配合物,这与碱性条件下的XRD结构一致。立体化学模型表明是Si面进攻生成所需产物。
2.3 对碳碳不饱和键的不对称加成
3 磷手性二氢苯并氧杂膦烷配体在不对称环化反应中的应用
催化不对称环化是构建复杂多环骨架的强大工具[79,80]。磷手性二氢苯并氧杂膦烷配体被证明对多种类型的催化不对称环化反应非常有效,为天然产物合成提供了高效的合成方法。
3.1 不对称去芳构环化
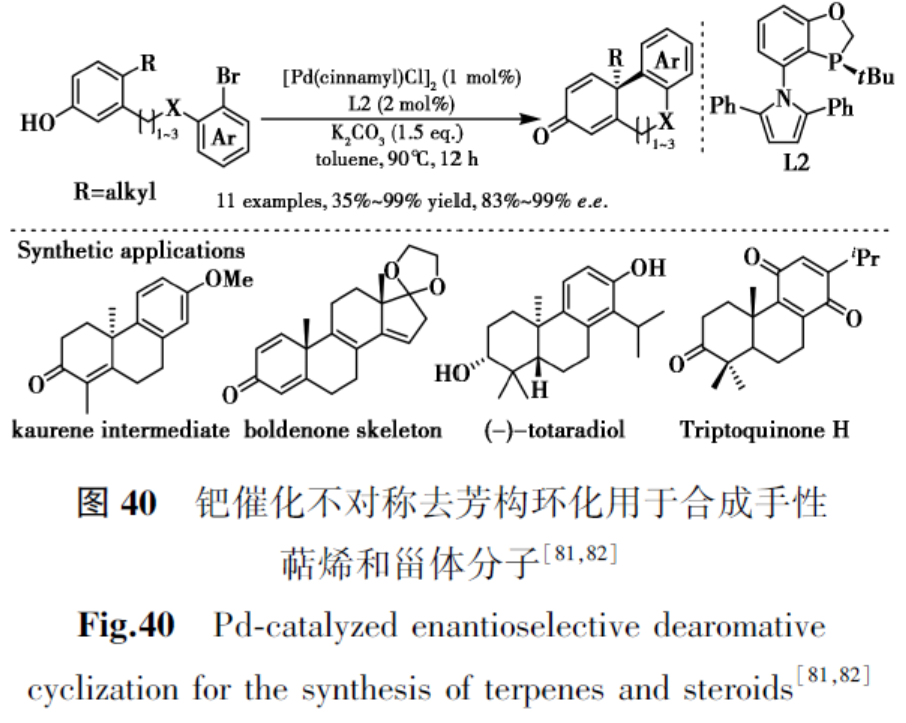
2015年,Tang等[81]开发了一种对映选择性钯催化带有取代酚部分的芳基卤化物的脱芳构环化,以优异对映选择性和中等至良好收率提供了一系列带有全碳季碳中心的手性菲酮衍生物(图40)。该方法能够以优异的对映选择性(高达99% e.e.)和产率实现系列含杂芳基或七元环的多环产物。提出的立体化学模型显示,配体L2的吡咯环上的苯基基团与配体磷中心的叔丁基的大位阻是高对映选择性关键。该方法在萜烯和甾体合成中的有效性通过高效合成贝壳杉烯(Kaurene)中间体、轻松构建合成代谢类固醇勃地酮(Boldenone)的骨架以及对抗菌二萜(-)-totaradiol的对映选择性全合成得到证明。本课题组随后通过钯催化脱芳构化策略完成了triptoquinone H及其差向异构体的合成[82]。
3.2 不对称环加成
Deng等[87]报道了使用BIDIME作为配体,钯催化4-乙烯基苯并噁嗪酮与羧酸的选择性脱羧[4+2]环加成,以中等至良好收率和良好至优异的立体选择性提供了一系列结构多样的带有两个连续手性中心的3,4-二氢喹啉-2-酮(图44)。

4 磷手性二氢苯并氧杂膦烷配体在不对称氢化反应中的应用
手性双膦配体是目前最成功和高效的配体,常用于不对称氢化。其中,磷手性双膦配体在不对称氢化中发挥了重要作用,能兼顾高立体选择性控制和高转化数(TONs)。
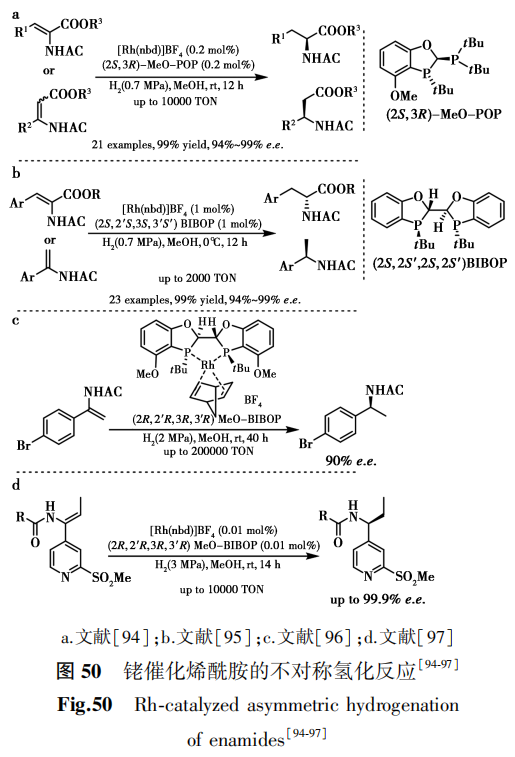
2010年,Tang等[94]开发了手性POP配体成功应用于铑催化α-(酰氨基)丙烯酸酯和β-(酰氨基)丙烯酸酯的不对称氢化反应中,对映选择性高达>99% e.e.,反应活性达10000 TON(图50a)。同年,Tang等[95]又设计合成了空气稳定且结构可调控的手性双膦配体BIBOP,成功应用于铑催化多官能团化烯烃的不对称氢化反应,对映选择性达99% e.e.,反应活性达2000 TON(图50b)。2013年,Tang等[96]实现了MeO-BIBOP公斤级合成,并将其铑配合物应用于N-乙酰基烯酰胺的不对称氢化中,反应转化数达200000 TON(图50c)。2014年,Reeves等[97]开发了利用铑-BIBOP催化烯酰胺的高对映选择性氢化,值得强调的是,在0.01 mol%催化剂负载量下以高达99.9% e.e.得到所需的手性氢化产物,并最终实现手性取代的吡啶药物中间体的制备(图50d)。
5 结论
自2010年首次报道以来,基于磷手性二氢苯并氧杂膦烷骨架的配体已超过百种被报道并成功应用于各种有机化学转化,在不对称催化和合成领域取得了显著的成就。磷手性二氢苯并氧杂膦烷配体是一类大位阻、富电子特性、性质稳定和结构易于修饰的膦配体。利用这些配体,已经开发出各种高效的金属催化不对称转化,包括不对称交叉偶联、不对称环化、不对称加成和不对称氢化,具有优异的反应活性、对映选择性和TONs,为复杂天然产物、手性药物及其中间体的合成提供了新的有效方法。特别是,由配体驱动的不对称交叉偶联和不对称氢化已频繁用于工业上的公斤级规模的药物发现和开发。毫无疑问,未来将会发现更多由磷手性二氢苯并氧杂膦烷配体主导的高效催化和合成,将在药物绿色工艺开发及工业化生产中发挥着更加突出的作用。
新的配体结构有利于发现新的反应活性和选择性,实现新的高效催化剂和反应。例如二氢苯并氧杂膦烷结构的发现促进了结构独特的双膦配体的开发,如WingPhos和MeO-BIBOP等;以及一系列不可替代的单膦配体,如BIDIME、AntPhos、BaryPhos以及手性BOPPO配体,这些配体在学术界和工业界的应用日益增多。配体的发展将会极大地促进更多有趣和有用反应的发现,如不对称碳氢键活化及不对称去芳构环化反应等。因此,继续开发具有新颖结构母核的配体以解决催化与合成中未解决的问题及挑战极为重要。希望本综述能鼓励读者继续从事配体的开发研究,以创造力和想象力在催化与合成中创造更多奇迹。
通讯作者介绍

汤文军
个人简介
上海有机化学研究所研究员、课题组长,硕士毕业于中国科学院上海有机化学研究所,博士毕业于美国宾夕法尼亚州立大学;在美国Scripps 研究所从事博士后研究,后加入美国Boehringer Ingelheim药业公司药物工艺部门任高级科学家, 后升任首席科学家;2011年起任上海有机化学研究所研究员、课题组长,2015年获中国均相催化青年奖,2017年获国家杰出青年基金资助,2018年入选科技部中青年科技创新领军人才,2019年获药明康德生命化学研究奖学者奖,2024年获得英国皇家化学会学术奖励,同年获得上海市自然科学奖一等奖。
主要研究方向
发展高效、实用、绿色的催化反应方法学实现药物分子的(不对称)合成;
利用绿色催化方法学,实现复杂天然产物全合成;
开发可规模化生产、成本可控、高效的药物或农药分子合成新工艺
近五年代表作
1. Yang, H.; Sun, J.; Gu, W.; Tang, W. Enantioselective Cross-Coupling for Axially Chiral Tetra-ortho-Substituted Biaryls and Asymmetric Synthesis of Gossypol. J. Am. Chem. Soc. 2020, 142, 8036-8043.
2. Yang, H.; Tang, W. Enantioselective Construction of ortho-Sulfur- or Nitrogen-Substituted Axially Chiral Biaryls and Asymmetric Synthesis of Isoplagiochin D. Nat. Commun. 2022, 13, 4577
3. Zhou, M.; Li, K.; Chen, D.; Xu, R.; Xu, G.; Tang, W. Enantioselective Reductive Coupling of Imines Templated by Chiral Diboron. J. Am. Chem. Soc. 2020, 142, 10337-10342.
4. Lin, Y.; Xu, G.; Tang, W. Chiral Polymeric Diamine Ligands for Iridium-Catalyzed Asymmetric Transfer Hydrogenation. J. Am. Chem. Soc. 2024, 146, 27736-27744.
5. Zhu, Y.; Zhang, Y.; He, D.; Yang, H.; Xue, X.-S.; Tang, W. Rhodium-Catalyzed Asymmetric Reductive Hydroformylation of α-Substituted Enamides. J. Am. Chem. Soc. 2024, 146, 33249-33257.
6. 曹振,徐广庆,罗林,汤文军.磷手性二氢苯并氧杂膦烷配体在催化与合成中的应用[J].化学试剂,2025,47(12):1-20.
团队照片

主页链接:http://wenjuntang.sioc.ac.cn/



