背景介绍
本文亮点
1、根据多靶点定向配体策略,以灯盏乙素苷元为骨架,通过不同的连接体,连接N,N-双取代氨基甲酸酯片段和炔丙胺,N-甲基炔丙胺片段,设计并合成抗AD灯盏乙素苷元衍生物;
2、基于AD的胆碱酯酶假说和单胺氧化酶假说,根据Ellama法和Holt法,进行酶活性测试,2-(4-((二甲基氨基甲酰基)氧基)苯基)-5,6-二羟基-4-氧代-4H-色烯-7-基5-(甲基(丙-2-炔-1-基)氨基)-5-氧代戊酸酯对两种酶表现出较好的抑制活性;
3、目标化合物可能是一个具有潜力的抗AD化合物,有待在抗氧化活性、金属离子螯合、肝微粒体代谢等抗AD活性实验中进一步研究。
内容介绍
1 实验部分
1.1 主要仪器与试剂
1.2 实验步骤
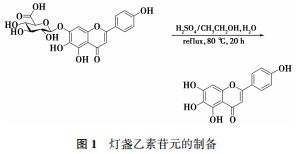
1.2.1 灯盏乙素苷元的制备
1.2.2 二苯缩酮保护的灯盏乙素苷元的合成
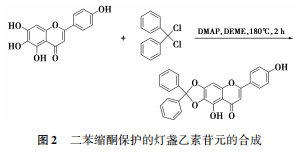
在250mL的干燥洁净圆底烧瓶中,加入500mg(1.75mmol)灯盏乙素苷元,加入14mL二乙二醇二甲醚(DEME)将苷元溶解,加入251.6mg(1.75mmol)对二甲氨基吡啶(DMAP),常温搅拌下缓慢滴加二氯二苯甲烷,滴毕,将体系升温回流反应2h。反应结束后,加入适量石油醚,待晶体析出完全后,去上清液,残余物经硅胶柱层析分离纯化,洗脱剂为V(甲醇)∶V(二氯甲烷)=1:70,得橘黄色粉末,产率为65%。
1.3 胆碱酯酶活性测试以及酶动力学测试
1.4 单胺氧化酶活性测试
1.5 化合物抑制/解聚Aβ1-42聚集活性实验
1.6 透射电镜(TEM)观察Cu2+诱导的Aβ1-42聚集/解聚
2 结果与讨论
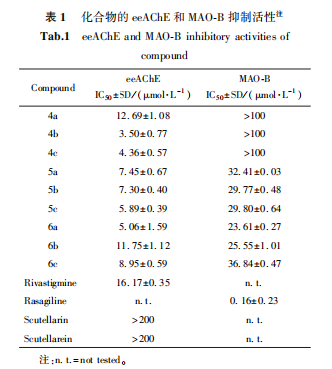
2.1 酶活性测试结果
如表1所示,所有的目标化合物对eeAChE均显示了不同程度的抑制活性,IC50值范围为3.50~12.69μmol/L,均优于阳性药,这表明N,N-双取代氨基甲酸酯的引入是抑制胆碱酯酶活性的关键。其中化合物4b、4c、6a抑制作用较好,有待进一步的研究。
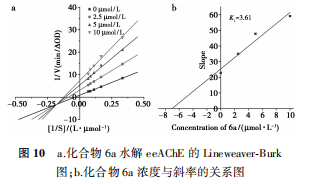
2.2 酶动力学实验结果
基于上述结果,选择化合物6a进行eeAChE动力学研究,结果如图10a所示,eeAChE的Lineweaver-Burker图中所有的直线在第三象限中相交于一点,随着化合物(抑制剂)浓度的增加,斜率和截距都增加(即Vmax减少,Km增加),这一结果表明,化合物对eeAChE抑制机理为混合型抑制。以Lineweaver-Burker图中斜率对化合物浓度作图,如图10b所示,得抑制常数Ki值为3.61,表明化合物的抑制能力较强。
2.3 抑制/解聚Aβ1-42聚集活性实验结果
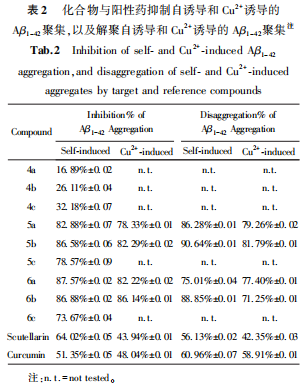
2.4 透射电镜(TEM)观察Cu2+诱导的Aβ1-42聚集/解聚
结果见图11,未孵育过的Aβ1-42在电镜下呈比较规整分散的圆形颗粒,Aβ1-42与Cu2+单独孵育24h后聚集成不规则的纤维状,Aβ1-42与Cu2+单独孵育48h后聚集成不规则的纤维状较24h更明显。加入姜黄素和化合物6a后,聚集减少,且与化合物6a孵育的Aβ1-42聚集程度比与姜黄素孵育的Aβ1-42聚集程度明显减少。表明化合物能够有效抑制/解聚Cu2+诱导聚集,且抑制/解聚Cu2+诱导聚集的效果比姜黄素要好。透射电镜结果与硫磺素T法测得的结果一致。
3 结论
根据多靶点导向配体策略(MTDLs),设计并合成9个双靶点抗阿尔兹海默症灯盏乙素苷元衍生物。结构通过1HNMR、13CNMR、ESI-MS进行确证,9个终产物(化合物4a~4c、化合物5a~5c、化合物6a~6c)总产率范围在14.46%~19.37%之间。基于AD的胆碱酯酶假说和单胺氧化酶假说,根据Ellama法和Holt法,进行酶活性测试。结果表明,2-(4-((二甲基氨基甲酰基)氧基)苯基)-5,6-二羟基-4-氧代-4H-色烯-7-基5-(甲基(丙-2-炔-1-基)氨基)-5-氧代戊酸酯(6a)对两种酶表现出较好的抑制活性,对eeAChE的IC50为(5.06±1.59)μmol/L,对MAO-B的IC50为(23.61±0.27)μmol/L。化合物6a与eeAChE的酶动力学表明化合物6a对eeAChE是混合型抑制。
化合物6a不仅对自身和Cu2+诱导的Aβ1-42聚集具有良好的抑制作用(87.57%和82.22%),而且还能诱导自身和Cu2+诱导的Aβ1-42原纤维的分解(75.01%和77.40%)。透射电镜实验证明了这一现象。实验表明,化合物6a可能是一个具有潜力的抗AD化合物,有待在抗氧化活性、金属离子配位、肝微粒体代谢等抗AD活性实验中进一步研究。



