
头图潜台词:假的真不了——出自《我不是药神》
《我不是药神》上映四天了。专利人的朋友圈被各种专利科普文充斥着。
我写了两篇了,第二篇尤其针对药品的专利强制许可,进行了没有太深入的探讨,就怕大家误解了。
但是,有些知产媒体的科普文章还是存在一些错误。毕竟是要推广专利,那么还是靠谱一点好。而且药品的问题不只是专利的事,把视野局限在专利上就不对了。
所以,百科君还是退一步,把他们没有回答好的问题替他们重新答一下。
本文采用的问题来自公众号知产库7月6日的《神药为什么不可以在中国强制许可》
1、“专利垄断”带来的巨大差价?
错误解读:
“拿电影中的说法,瑞士的是“正版药”,印度的是仿制药,那巨大的差价就是专利的价格。...专利是一种法律保障的垄断权,自然会产生垄断的高价。”
百科君解读:
首先,专利和垄断,不是一个概念,放在一起说也并不合适。专利是法定的排他权,限制别人的抄袭;而正常行使知识产权并不叫垄断,搞小动作限制竞争,那才可能算是垄断。
其次,专利药,或者我们叫它原研药,20000块价格较之仿制药千把块的价格,差的并不是专利导致的价格上升。
专利只是防止别人制造、销售你的专利产品。但是,专利药也就是原研药,背后包含的是巨额的研发成本。
诺华公司2007年到2011年之间的研发成本是836亿美金,然而被批准上市的药只有21种,而且并不是每一种都能卖出好价格的。这800多亿美金,放在2009年可以买800个C罗;放在今年,可以买400个姆巴佩。
当然,研发成本还要细分,我们可以粗略的分为:
前期药物筛选的成本+后期做临床实验的成本
因为药品必须是要安全的。上市之前必须一步一步论证要用在人体上安不安全的实验。这些实验从小白鼠做到兔子、狗,再做到猴子、猩猩,最后做志愿者身上,一是花钱,二是要时间,三是大部分做一半效果太差就得终止,前面的工作就全浪费,这都是成本。
所以细化一下的研发成本结构是:
前期药物筛选的成本+各阶段临床实验的成本+测试失败的成本
所以,第一颗新药的成本是几十亿美金,这是没错的。
而如果要在我国的市场上销售仿制药,无论是我国企业自己做的仿制药,还是外国生产的仿制药进口进来(比如印度),都是要去药监局备案,然后做临床实验、一致性评价测试等等,这些成本还是省不了,为的就是保证这些药用在我国患者身上的安全性。所以主要降下来的是前期药物筛选的成本+测试失败的成本。
但是如果你这药是印度人肉背回来的仿制药,没有在我国注册,所以它连临床的测试的成本也都没有。
当然,这还不是最主要的。
如果第一颗新药价值几十亿美元,那么第二颗药的价格还分出厂价格和到你手上的价格 。
直接来讲,就算药物批准在国内上市了,它进入市场,进入各级医院,进入医保名录,各级销售(含医院)、推广等等的费用,都又构成了从出厂到你手上的渠道销售成本,当然还包括各个层级的定价、加价。
所以,你看看从印度人肉背回来的仿制药,光从看的到的成本上来说,省了多少成本?
比原研药就少了前期药物筛选的成本+各阶段临床实验的成本+测试失败的成本+渠道销售成本;
比正规仿制药(国产或者进口)、原研药的进口药,少了+各阶段临床实验的成本+渠道销售成本;
所以,拿非注册的印度仿制药来和正规药品比价格,是没有可比性的。而你又把它归结到“专利垄断”,第一误解了垄断;第二,抹黑了专利,第三,误导了读者。
2. 为什么印度可以仿制专利神药格列卫?
错误解读:
有些文章的解读是印度政府给了格列卫强制许可。
百科君解读:
印度1995年申请加入WTO之后,设立了10年过渡期。在此这10年中,仍然沿用其1970年的专利法,即印度政府仍然可以拒绝药物产品的专利。所以1995年之前的抢仿药仍将游离于专利法之外。这是大环境。
而从格列卫在美国FDA(药品食品监督局)橙皮书登记的专利来看,一共涉及四件专利,最早的化合物专利US5521184A申请于1994年,早于1995年。它以及后面的US6958335B2、US6894051B1、USRE043932E也都没有对应的印度专利保护。
所以,只要印度的药品监管部门批准,印度药企就可以仿制格列卫,至于临床实验什么的,只听说,比较乱...好在“印度格列卫”Veenat的口碑还比较好。
而据说印度的第一例强制许可的仿制药诞生于2012年。
3. 为什么中国不可以仿制神药格列卫?
错误解读:
“格列卫在中国有专利”
百科君解读:
如果你的问题是为什么在中国不可以制造、销售、许诺销售格列卫,那你的答案是,因为格列卫在中国有专利,这样的回答是严谨的。因为中国专利法禁止的就是以上侵犯专利权的行为。
但是,如果你的题目问的是,为什么不可以在中国仿制格列卫。那这个问题一定不能用专利来回答,而是应该用药监局的视角来回答。
因为,能不能仿制一种原研药,一定是要获得药监局批准的,而且怎么申请,怎么批准,批准几个都是有规定的。
而知识产权问题,也必须是药监局在审批时不得不尊重的。虽然格列卫的在中国专利失效后,仿制药才能上市,但是在专利失效之前,你想在政策允许的时间内,开展活性成分合成、剂型仿制、临床实验、一致性评价等一系列仿制工作,为上市做准备,这些都是允许的,但是需要提前在药监局备案。
可以说,仿制格列卫的工作,在专利法允许的范畴,药监局允许的范围内,是可以在中国格列卫专利有效期内进行的;但是生产、上市仿制出来的格列卫,必须是在我国药监局批准之后,原研药专利失效之后才能进行的。
现有已批准的格列卫仿制药如下:
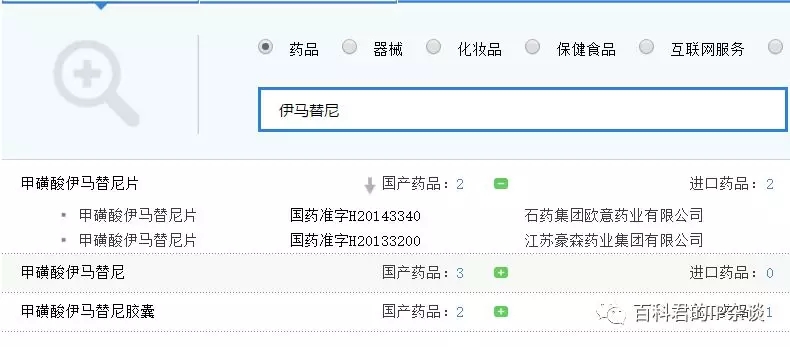
4. 为什么不能从印度 / 其他国家进口神药格列卫?
错误解读:
因为格列卫在中国有专利,所以不能从印度进口仿制的格列卫,否则会侵犯格列卫在中国的专利权。
诺华公司会防止你从格列卫便宜的国家购买,再卖到中国的“串货”行为。
百科君解读:
从其他国家进口药,再到中国进行销售。不是你想干就干的。因为药品不是一般的商品。
简单来说,不管你进口的药是来自印度的仿制药,还是美国原产的正品药,你想光明正大的在中国市场堂而皇之的卖掉,是需要药监局批准的。
因为这些药是要给国人用,你就要通过一系列的临床实验、一致性评价试验来证明给中国人吃了是有效果的,安全的,而且需要去药监局拿到“国药准字”的号,否则都是卖!假!药!
对的,你没有看错,无论你卖的是印度仿制的格列卫,还是美国原装进口的格列卫,只要没有在我国药监部门注册,你们卖假药的性质是一样的!
而为什么不先考虑专利侵权的问题呢?
侵犯专利权,大部分是民事责任;但是卖假药,直接就是刑事责任,是要坐牢的!你说哪个严重?
5. 为什么不能适用权利用尽原则?
错误解读:
格列卫在印度根本就没有专利权,仿制当然不是诺华公司的授权行为。
所以权利用尽原则对印度仿制的格列卫根本不适用。
百科君解读:
我不知道上述的答案是什么逻辑。
所谓专利权用尽,应该指的是如果你从美国买了正规的格列卫,然后在把格列卫人肉扛到中国,然后加价卖出去。这种行为才可以讨论,是否能用专利权用尽原则,来针对诺华公司在中国的专利,进行不侵权抗辩。
当然,如果你从美国的药店直接购买,且没有什么其它附加条件。从美国近年来的判例来看,是属于专利权用尽的。在美国是允许你出口到中国的。
但是,在中国你会遇到的最大的麻烦还是来自诺华公司。他们会对市场做监控,也许你在自家药店卖自己进口的美国格列卫,不用多久就会被诺华发现。
但是,诺华一定不会用专利侵权来整治你,一定是直接投诉你卖!假!药!
根本不会给你专利权用尽,进行不侵权抗辩的机会...然后,你直接就进去了...
6. 为什么中国不可以强制许可专利神药格列卫?
错误解读:
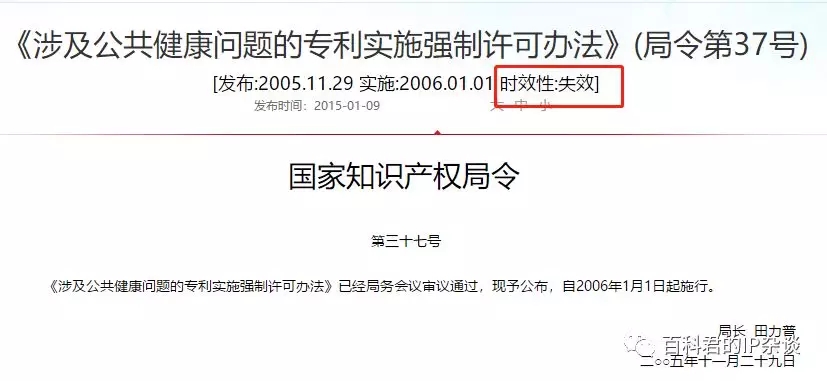
2005年,中国国家知识产权局根据《多哈宣言》和中国专利法,发布了《涉及公共健康问题的专利实施强制许可办法》,而电影《我不是药神》中的慢粒白血病,不是传染病。
百科君解读:
我的天哪,你居然拿一个失效的部门规章来说事儿!
强制许可的问题百科君已经在前文《“药神“的锅?专利强制许可,不背!》中进行阐述。专利强制许可的依据,是专利法整整第六章的内容,涉及第48-58条。能跟在本国市场 、药品专利、 强制许可扯上关系的理由,是48、49条。
至于,国家知识产权为为啥不批准强制许可的申请,首先,你需要有一个被药监局批准,可以生产仿制格列卫的申请人提交申请;其次,必须发生符合专利法48、49条规定的“未实施”、“反垄断”、“紧急状态”、“公共利益”等情形。具体看我的前文吧,不再复述。
你如果一定想用部门规章来说事儿的话,请参考2012年实施的 《专利实施强制许可办法》,这个是现行有效的。但至于为什么国内没有实施过一次专利强制许可,大体因为是没!必!要!具体也还是看前文吧。
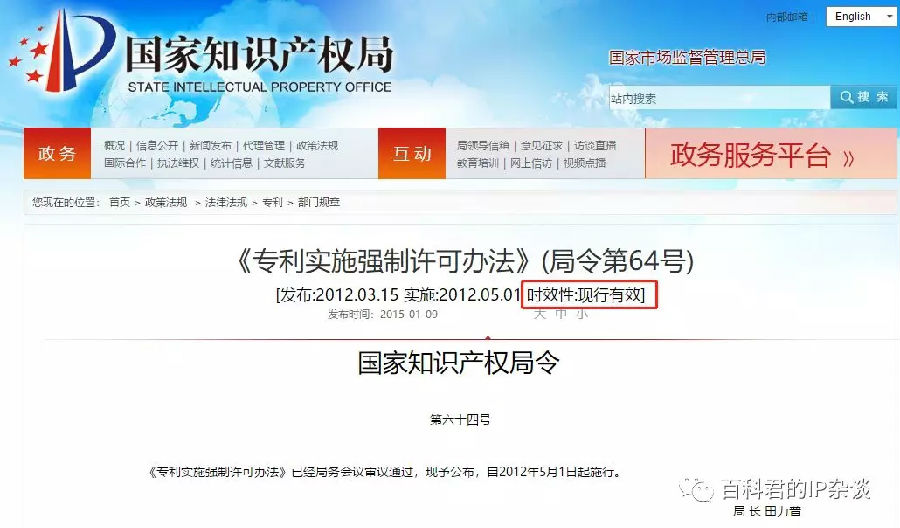

链接为:http://www.sipo.gov.cn/zcfg/zcfgflfg/flfgzl/zlbmgz/1020112.htm
如果看到还有离谱的文章,那再继续写吧...



